 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Comúnmente, en muchos laboratorios se utilizan soluciones de concentración, conocida como base, para la preparación de soluciones más diluidas o concentradas, adicionando mayor cantidad de solvente en el caso de las soluciones diluidas, o mayor cantidad de soluto y calentando para eliminar cantidad de solvente, en el caso de soluciones más concentradas.
Estudiemos ahora las diferentes situaciones problemáticas que puedan presentarse al preparar soluciones diluidas y soluciones concentradas.
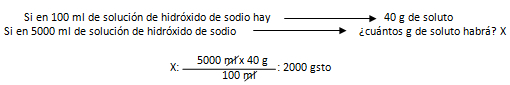
1. Calcule la concentración de una solución que ha sido preparada añadiéndole 2 L de agua a 5.000 ml de solución al 40 % en m/v de hidróxido de sodio.
Vste: 2 L de agua g; vsol: 5.000 ml ; % m/v inicial: 40 m/v de hidróxido de sodio; % m/v final: ¿? ; gsto: ¿?
Por lo ya estudiado, sabemos que el 40 % en m/v nos indica que por cada 100 ml de solución que se necesite preparar, se requieren 40 g de soluto. Realizando un regla de tres, por medio de dicho razonamiento, podemos calcular una de nuestras incógnitas:
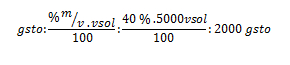
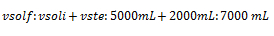
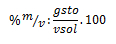
Sustituyendo ahora el la fórmula del porcentaje, nos queda:
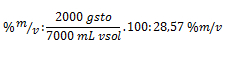
2. Se calienta una solución de 1.000 ml de sal común (NaCl) y agua al 10 % en m/v, la cual se evapora hasta llegar a un volumen de 700 ml. Calcule la concentración en % en m/v de la solución final.
Vsol1: 1.000 ml de agua salada; vsol2: 700 ml; % m/v inicial: 40 m/v de hidróxido de sodio; % en m/v: ¿? ; gsto: ¿?
Por lo ya estudiado, sabemos que el 10 % en m/v nos indica que por cada 100 ml de solución que se necesite preparar, se requieren 10 g de soluto. Realizando un regla de tres, por medio de dicho razonamiento, podemos calcular una de nuestras incógnitas:
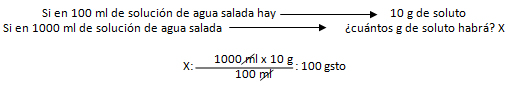
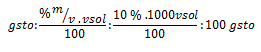
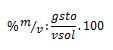
Sustituyendo ahora el la fórmula del porcentaje, nos queda:
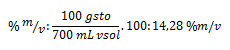
Autoevaluación.
1. Determinar la concentración de una solución de 1 L al 13 % en m/v a la cual se le ha adicionado 1.500 ml. Realice los cálculos a través de los dos métodos estudiados.
2. Se calienta una solución de 1.800 ml de sal común (NaCl) y agua al 45 % en m/v, la cual se evapora hasta llegar a un volumen de 600 ml. Calcule la concentración en % en m/v de la solución final. Realice los cálculos a través de los dos métodos estudiados.
Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág.: 37-40.
Suarez, F (1994). Química teoría. 9no grado de Educación media general. Editorial Romor. Caracas, Venezuela. Pág.: 40 - 41.
Suarez, F (2011). Química teoría. 4to año de Educación media general. Editorial Romor. Caracas, Venezuela. Pág.: 39- 40.