 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Los cambios que se producen en las sustancias pueden ser de dos tipos: cambios físicos o cambios químicos.
Cuando una sustancia experimenta un cambio físico, sus propiedades cambian poco pero la sustancia sigue manteniendo su identidad. Los cambios de estado son ejemplo de un cambio físico, como en el agua, en donde en función a la temperatura, puede transformarse del estado sólido, a líquido y a gaseoso.
Cuando una sustancia experimenta un cambio químico, sus propiedades cambian completamente, lo que supone que se ha generado una modificación profunda de la que resultan nuevas sustancias. Las reacciones químicas son un ejemplo de cambio químico.
En las reacciones químicas existirá dos estados, el primero, el estado inicial donde hay unas sustancias denominadas reactivos, y un estado final en donde se hallan las nuevas sustancias denominadas productos. En comparación a los cambios físicos, los cambios químicos requieren de procesos más complicados acompañados de variaciones de energía. Suelen ser duraderos, es decir, persisten cuando ya no existe la causa que los originó.
En la naturaleza se pueden observar miles de ejemplos de cambios químicos, como la fotosíntesis en las plantas, la combustión de los automóviles, la oxidación de los metales, entre otros.
LEYES DE LAS REACCIONES QUÍMICAS
Las leyes de las reacciones químicas son las que tratan de las cantidades de las sustancias que intervienen en las reacciones, dividiéndose en dos grupos, las ponderales y las volumétricas.
Esta ley enuncia que la masa de los reaccionantes es igual a la masa de los productos de la reacción. Esta ley puede estudiarse a través del siguiente ejemplo: se tiene la siguiente reacción, hallar la masa de los reactivos y de los productos:

Esta ley enuncia que cuando dos o más elementos se combinan entre sí para formar a un determinado compuesto, lo hacen en una relación en peso invariable. Un ejemplo de ello es en el agua, en donde la relación entre el hidrógeno y el oxígeno siempre es 1/8; de no ser así la sustancia no es agua.
La ley de Dalton enuncia que las cantidades de un elemento que se une con una cantidad fija de otro elemento para formar distintos compuestos, está en relación de números enteros sencillos. Esta ley puede comprenderse, estudiando a los diferentes óxidos del nitrógeno posibles (tabla 1):
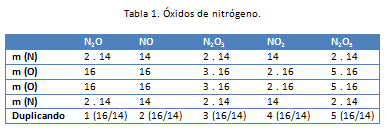
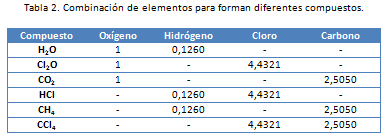
Esta ley enuncia que las cantidades de los diferentes elementos que se unen con una misma cantidad de un elemento dado son los pesos relativos de aquellos elementos, es decir, múltiplos o submúltiplos, cuando se combinan entre si. En la tabla 2 se puede observar que 1gramo de oxígeno reacciona con unas cantidades de otros elementos para forman los cinco primeros compuestos y que, cuando estos elementos lo hacen entre sí, es en las mismas proporciones.
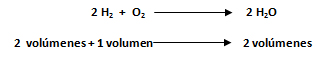
En cualquier reacción química los volúmenes de las sustancias gaseosas que intervienen están en relación de números enteros sencillos. El volumen resultante es inferior o, como máximo, igual a la suma de los volúmenes reaccionantes. Esta ley puede estudiarse a través del siguiente ejemplo de la reacción de formación de agua:
El principio de Avogadro indica que volúmenes iguales de gases distintos a la misma presión y temperatura tienen el mismo número de moléculas o, lo que es lo mismo, el volumen ocupado por un mol de cualquier gas, en las mismas condiciones de temperatura y presión (1 atmósfera, y 0 ° C), es el mismo. Este volumen es conocido como volumen molar, que equivale a 22, 4 litros.
Referencias bibliográficas:
Ramos, F; Caballero, A (2000). Química teoría. 1er año Ciclo Diversificado. Ciencias y Ciclo Profesional. Caracas, Venezuela. Pág: 76-99.