 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS
Las propiedades físicas de las disoluciones moleculares solo dependen del número de partículas que hay en la disolución. Cuando el soluto tiene características iónicas en disolución, se dice que se encuentra disociado. El número de partículas dependerá de cada compuesto, por lo que solo se aplican a solutos moleculares.
Estas propiedades son denominadas propiedades coligativas, como la presión de vapor, la temperatura de ebullición, la temperatura de congelación y la ósmosis:
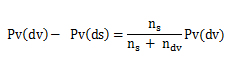
Donde Pv(dv), es la presión de vapor del disolvente, Pv(ds) es la presión de vapor de la disolución, ns son los moles de soluto y ndv los moles del disolvente. A una misma temperatura hay menos moléculas que hayan pasado a estado de vapor en la disolución que en el disolvente puro.
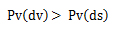
Esto se debe a que las moléculas de soluto atraen a las de disolvente, por lo que a éstas les cuesta más escaparse, es decir, evaporarse. La cantidad de moléculas que están en forma de vapor es menor y por tanto también es menor la presión que ejercen.
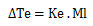
Donde Ke es la constante ebulloscópica del disolvente (agua, 0,52 °C Kg/mol) y Ml la molalidad.
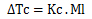
Donde Kc es la constante crioscópica del disolvente (agua, 1,86 °C Kg/mol) y Ml la molalidad. Un ejemplo de la aplicación de dicha propiedad son los anticoagulantes que se utilizan en los automóviles de los países fríos.

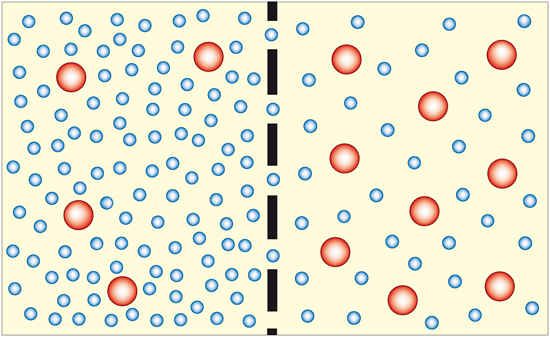
Este fenómeno tiene mucha importancia en los seres vivos ya que la membrana celular actúa como una membrana semipermeable (transporte pasivo).

Referencias bibliográficas:
Cuerpo de redacción (1997). Mentor interactivo. Enciclopedia temática estudiantil. Editorial Océano. Barcelona, España. Pág: 150-154.
Cuerpo de redacción (1989). Atlas visual de la ciencia. Editorial Océano. Barcelona, España. Pág: 500-502.