Los catalizadores son sustancias que aceleran el transcurso de una reacción química, sin intervenir en ella, estos pueden ser biológicos o químicos, entre los biológicos podemos nombrar a las enzimas, que son proteínas altamente especializadas, de gran tamaño molecular y amplia variabilidad que tienen como función la regulación de la velocidad de las reacciones químicas que se llevan a cabo en los seres vivos.
¿QUÉ SON LAS ENZIMAS?
Las enzimas son moléculas orgánicas, generalmente proteicas que actúan como catalizadores eficaces y muy específicos, estas incrementan notablemente la velocidad de reacción gracias a que disminuyen la energía de activación, es decir, la cantidad de energía necesaria para que ocurra la reacción. Logran esto al unirse a un sustrato y sostenerlo tal manera que permite que la reacción ocurra más eficientemente.
Las enzimas aceptan sustratos altamente específicos, es decir, catalizan una sola reacción o un grupo pequeño de reacciones similares, su actividad catalítica depende de la integridad de su conformación nativa.
CARACTERÍSTICAS DE LAS ENZIMAS
- Son eficientes en pequeñas cantidades.
- No son alteradas químicamente por la reacción y se recuperan intactas una vez finalizada la misma.
- No afectan las condiciones de equilibrio de la reacción, solo hace que este equilibrio se alcance más rápidamente.
- Son específicas, catalizan una reacción en particular.
- Su actividad es regulable.
- Tienen una composición química determinada.
TIPOS DE ENZIMAS
Las enzimas se clasifican de acuerdo al tipo de reacción que catalizan, existen seis grandes grupos de enzimas:
- Oxidorreductasas: regulan reacciones de oxido – reducción (REDOX).
- Transferasas: transfieren grupos funcionales.
- Hidrolasas: ruptura de enlaces por medio de agua.
- Liasas: ruptura o formación de moléculas sin intervención de agua.
- Isomerasas: cambio de posición de grupos dentro de la molécula.
- Ligasas: formación de enlaces dependiente de ATP.
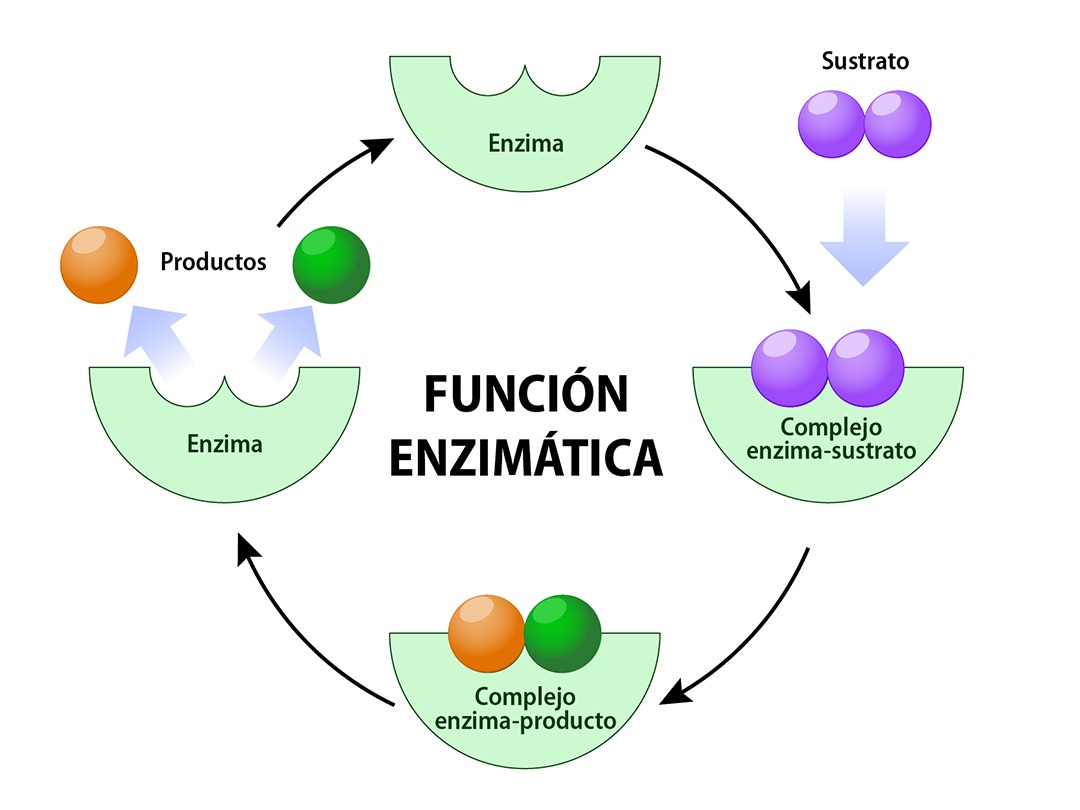
¿CÓMO OCURRE LA REACCIÓN?
En una reacción catalizada por una enzima:
![]()
- La sustancia sobre la que actúa la enzima se llama sustrato.
- El sustrato se une a la región concreta de la enzima, llamada centro activo, que es la zona donde se realiza la catálisis enzimática, aquí la enzima cambia levemente de forma, encaja perfectamente con el sustrato y forma el complejo enzima/substrato.
- Una vez formados los productos, se forma el complejo enzima/producto, luego estos son liberados y la enzima puede comenzar un nuevo ciclo de reacción.
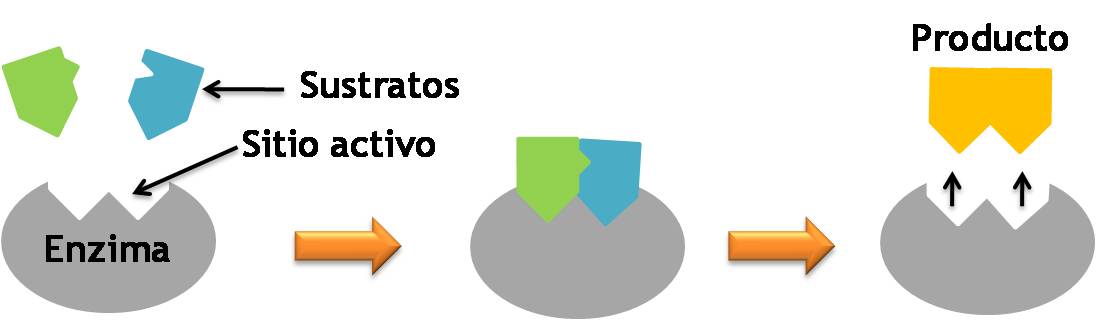
Modelos de acción enzimática
Existen dos modelos de acción enzimática, estos son:
- Modelo llave-cerradura: este modelo fue propuesto por el químico Emil Fisher. Establece que la estructura del sustrato y la del sitio activo son exactamente complementarias, de la misma forma que una llave encaja en una cerradura. Este modelo es válido pero no siempre se considera correcto.
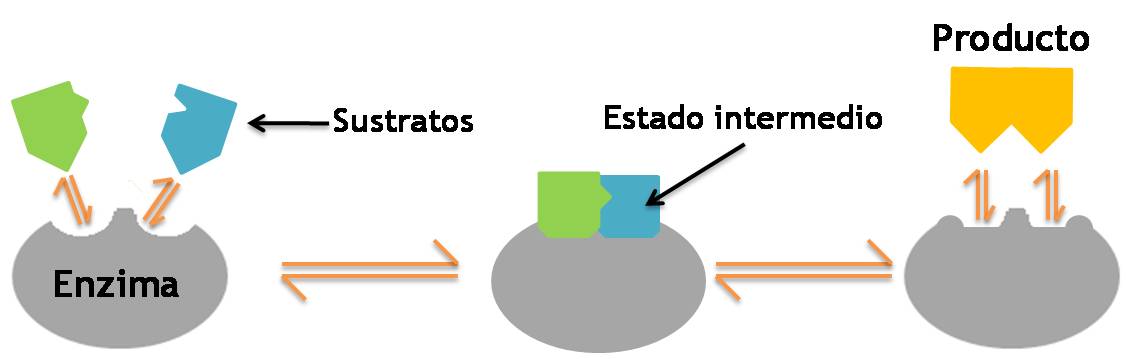
- Modelo de encaje inducido:establece que el sitio activo es mucho más flexible que una cerradura, la interacción física entre las moléculas de enzima y sustrato produce un cambio en la geometría del centro activo, mediante la distorsión de las superficies moleculares. Este modelo atribuiría cierta tensión a las moléculas reaccionantes, facilitando aún más la reacción.
¿QUÉ FACTORES AFECTAN LA ACTIVIDAD ENZIMÁTICA?
Las propiedades de las enzimas se deben a que son proteínas y actúan como catalizadores, es por ello que poseen una conformación natural más estable que las demás conformaciones posibles, por lo tanto, cambios en la conformación suelen ir asociados en cambios en la actividad catalítica.
Existen factores que influyen de manera más directa sobre la actividad de una enzima, estas funcionan mejor dentro de rangos de temperatura y de pH específicos, y bajo condiciones que no son las óptimas una enzima puede perder su capacidad de unirse a un sustrato.
Los factores que influyen de manera más directa sobre la actividad catalítica son:
- pH: cada enzima tiene un rango óptimo de pH, alterar el pH fuera del rango establecido hará más lenta la actividad de la enzima y valores de pH extremos pueden causar la desnaturalización de la misma.
- Temperatura: habitualmente al incrementar la temperatura se logra acelerar velocidad de la reacción, y si por el contrario se disminuye la hace más lenta, sin embargo, temperaturas considerablemente altas pueden causar la desnaturalización de la enzima y por tanto dejará de trabajar.
- Concentración de la enzima: niveles altos de concentración de la enzima acelerará la reacción, siempre que encuentre sustrato al cual unirse, cuando todo el sustrato esté adherido, la reacción deja de acelerarse, debido a que no hay sustrato para las enzimas adicionales.
- Concentración del sustrato: niveles altos en la concentración del sustrato también incrementa la velocidad de reacción, sin embargo, una vez que todas las enzimas se han unido al sustrato, estarán saturadas, por lo tanto, un incremento en la concentración del sustrato no tendrá un impacto alguno en la velocidad de reacción.
¿QUÉ SON LOS COFACTORES?
Los cofactores son sustancias no proteicas que colaboran en la catálisis, pueden ser iones inorgánicos como el Fe++, Mg++, Mn++, Zn++ etc. En ocasiones, las enzimas requieren para su funcionamiento la presencia de estas sustancias, de hecho casi un tercio de las enzimas requieren cofactores, cuando este cofactor es una molecula orgánica se le denomina coenzima, la mayoría de estas son sintetizadas a partir de vitaminas; cuando existe un enlace covalente entre un cofactor y una coenzima se llaman grupos prostéticos y la enzima unida a este grupo prostético es denominada holoenzima y la parte inactiva o proteica de esta holoenzima se llama apoenzima, por lo tanto:
apoenzima + grupo prostético = holoenzima




 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS