Impacto ambiental y catástrofes naturales | ¿qué aprendimos?
IMPACTO SOBRE LA BIÓSFERA
La biósfera es el subsistema que sustenta la vida de la superficie de la Tierra, se extiende desde la atmósfera hasta las zonas más profundas del océano. La biósfera es un ecosistema global compuesto por organismos vivos (biota) y factores abióticos (no vivos). De todos los seres vivos que habitan en el planeta, el hombre, con su modo de vida, provoca que su impacto en la Tierra sea mayor que el causado por cualquier otra especie. Dentro de las actividades humanas que afectan la biósfera se encuentran: el uso de energías a base de carbón, las cuales aumentan los gases de efecto invernadero; la deforestación, la cual contribuye con eliminar a los pulmones naturales del planeta; y la quema de basura, que genera gases tóxicos para el ambiente.

IMPACTOS EN LA TRAMA TRÓFICA
Se conoce como red trófica a la interconexión natural entre las cadenas tróficas de un ecosistema determinado. Cada uno de los compartimentos por los que fluye la energía recibe el nombre de nivel trófico, y a su vez están conformados por las especies o los eslabones. Para que las relaciones entre los organismos que conforman cada una de las redes funcionen de manera adecuada debe existir un equilibrio. Entre las actividades que dañan las redes tróficas se encuentran: la deforestación, los incendios provocados, la minería, los vertidos industriales y la pesca indiscriminada. A largo plazo, todas ellas provocan la desaparición o disminución de varios eslabones, lo cual a su vez trae como consecuencia la desaparición de otras especies y por lo tanto un desequilibrio en los ecosistemas.

DESASTRES NATURALES E INDUCIDOS
Se define como desastre natural a la pérdida de vidas humanas o bienes materiales a causa de fenómenos naturales. En esta categoría se incluyen los terremotos, los cuales ocurren cuando la tierra libera energía acumulada y hace que el suelo tiemble, los huracanes, los tifones y los ciclones, mismo tipo de fenómeno meteorológico en el que una gran tormenta gira en círculos y supera los 118 km/h, los tsunamis, que se producen a causa de una erupción o un deslizamiento, las mangas de agua, fenómeno natural que ocurre en aguas tropicales, y las sequías e inundaciones. Por otro lado, los desastres inducidos son aquellos provocados por la acción del ser humano, como los incendios, la deforestación y la contaminación.

MOVIMIENTOS DE MASAS TERRESTRES
Las placas tectónicas se encuentran en constante movimiento. Sus bordes son activos, por lo que es frecuente que se produzcan fenómenos como los sismos, terremotos, tsunamis y erupciones volcánicas. Estas últimas, además de provocar la pérdida de muchas vidas humanas, tienen impactos graves en el medio ambiente, por ejemplo: la lluvia de cenizas, que modifica las características del agua, el humo, que posee gases nocivos tanto para el ser humano como para los seres vivos, y la lluvia ácida, la cual destruye la capa vegetal. Ante estas catástrofes existen medidas que suponen una prevención y garantizaran la posibilidad de sobrevivir, entre ellas se encuentran: identificar lugares seguros dentro o fuera del hogar, utilizar ropa que proteja la piel, alejarse de postes o cualquier objeto que tenga electricidad y, la más importante de todas, mantener la calma.

TEMPERATURA AMBIENTAL
El efecto invernadero es un proceso natural que calienta la superficie de la Tierra gracias a la presencia de ciertos gases que se encuentran en la atmósfera, como el dióxido de carbono, el vapor de agua, el metano, el ozono y los clorofluorocarbonos. Sin embargo, la actividad humana ha intensificado este fenómeno y algunas de las consecuencias de ello son: aumento de la radiación solar, acidificación de los océanos y derretimiento de los polos. Por otro lado, el calentamiento global es el aumento de la temperatura media de la atmósfera terrestre y del agua del mar. Algunas de las consecuencias de este fenómeno son: el deshielo de los casquetes polares, la disminución de la superficie cubierta por nieve o por hielo y la muerte de muchas especies, entre otras.

EVIDENCIAS DE DEGRADACIÓN DE LA CAPA DE OZONO
La capa de ozono es una capa profunda de la estratósfera que rodea la Tierra y protege todo nuestro planeta de gran parte de la radiación ultravioleta. A lo largo de los años, la capa de ozono se ha visto afectada por las actividades humanas. El agujero de la capa de ozono es una de las consecuencias de ello, es una zona donde la cantidad de ozono está reducida de manera anormal. Para evitar la continua degradación de la capa, se recomienda corroborar que los productos que se compran estén libres de compuestos dañinos, no utilizar productos que contengan sustancias que alteren la capa de ozono, como cloro y bromo y, sustituir los extintores que usen gas halón por aquellos elaborados a base de agua, gas carbónico, nitrógeno o argón.





 VOLVER A LOS ARTÍCULOS
VOLVER A LOS ARTÍCULOS











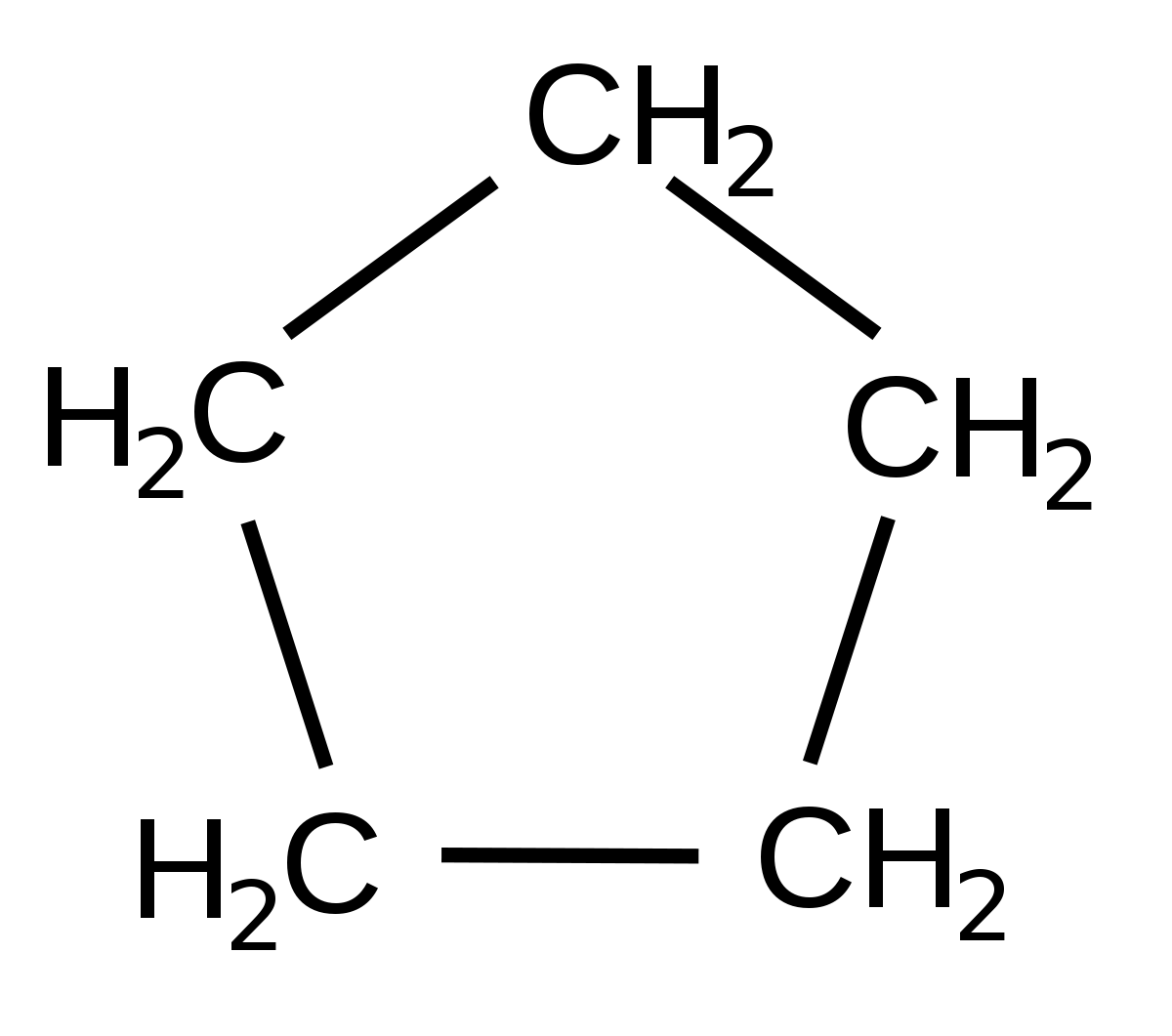
 1- penteno
1- penteno 1-penteno
1-penteno